Projekt der
Klassen 9a, 9b und 9c (NTG)
Bau
eines Kalorimeters und Bestimmung der molaren Reaktionsenergie von Eisensulfid
In
den Chemie-Profilstunden wurden dazu in jeder Übungsgruppe drei Arbeitsgruppen
gebildet, von denen jede nach den allgemeinen Plänen unseres Chemielehrers, des
Herrn Mahal, ein eigenes Kalorimeter bauen
sollte.
Ein
Kalorimeter ist ein chemisch-physikalisches
Versuchsgerät, mit dem die Wärmeenergie, die bei sog. exothermen Reaktionen frei
wird, bestimmt werden kann!
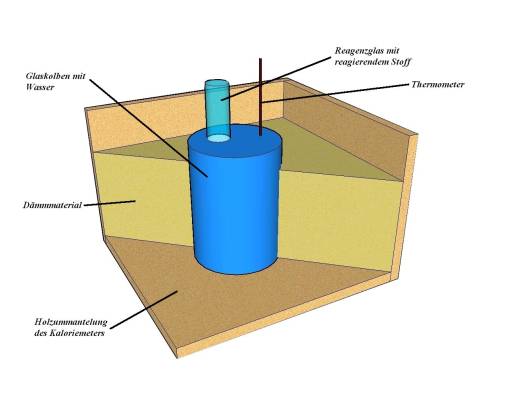
Beim
Bau der Apparatur sollte der prinzipielle Grundaufbau eines Kalorimeters (siehe
Bild) beachtet werden; jede Gruppe konnte allerdings ihre eigenen Vorstellungen,
etwa bei der Wärmedämmung oder der Auswahl der Materialien einbringen.
Grundbauplan eines Kalorimeters Die selbst gebauten Kalorimeter der Klasse
9b

Nach Abschluss der Bauphase und
einigen Vorversuchen wurden die fertigen Kalorimeter zur Bestimmung der molaren Reaktionsenergie
von Eisensulfid eingesetzt. Jede Arbeitsgruppe führte den Versuch in
ihrem eigenen Kalorimeter durch und erstellte dazu ein Versuchsprotokoll,
das
abgegeben und von H. Mahal korrigiert und auch (großzügig!) benotet wurde!
Durchführung des Versuchs
7g Eisenpulver wurden in einem Mörser mit 4g Schwefelpulver gut
vermengt. Von diesem Gemenge wurden exakt 4,4g abgewogen und in ein
kleines schwer schmelzbares Reagenzglas
gefüllt, welches wiederum in ein zweites, größeres Reagenzglas passte, das sich
bereits im Becherglas des
Kalorimeter befand. Dieses Becherglas
war mit 200ml Wasser befüllt. Die Wassertemperatur wurde mit 20,5°C gemessen!
Anschließend wurde das kleine
Reagenzglas mit dem Fe/S-Gemenge in der
Bunsenflamme erhitzt bis das Gemisch aufglühte, dann wurde das kleine Reagenzglas
möglichst schnell in das größere Reagenzglas im Becherglas des Kalorimeters
gestellt.
Nach Ablauf der heftigen
Reaktion im kleinen Reagenzglas wurde nun die Wassertemperatur im Becherglas wiederholt gemessen, bis sich ein
konstanter Wert von 26,1°C einstellte. (Die Temperaturmessungen wurden
mit einem digitalen Messgerät mit Thermofühler durchgefürt!)
Reaktion
![]() Fe + S
FeS
(Eisensulfid) ΔE < 0 (exotherm)
Fe + S
FeS
(Eisensulfid) ΔE < 0 (exotherm)
Berechnung
der Wärmemenge:
Q
= m ∙ c ∙ ∆T (Q = Wärmemenge; m = Masse des wärmeaufnehmenden
Mediums, hier Wasser;
c =
spezifische Wärmekapazität des Wassers; ∆T = Temperaturdifferenz in Kelvin )
![]()
Q = 200g ∙ 4,19 J/g∙K ∙
5,6K = 4692,8 J = 4,692 kJ
Die
molare Reaktionsenergie ∆Em
(hier auch Bildungsenergie) des Eisensulfids entspricht (bei konstantem Druck)
der abgegebenen Wärmeenergie des Systems bezogen auf die Stoffmenge 1mol und erhält definitionsgemäß ein negatives Vorzeichen!
∆Em = - Q : n
n = m:M
(n =
Stoffmenge in mol; m = Masse(Eisensulfid) in g ; M= Molare Masse Eisensulfid
in g/mol )
Hier: n = m : M = 4,4g : 88g/mol = 0,05mol
∆Em = - 4,692 kJ : 0,05 mol = - 93,856 kJ/mol
![]() Anmerkung: der Literaturwert dieser
Reaktion:
Anmerkung: der Literaturwert dieser
Reaktion:
∆Em (FeS) = -
100 kJ/mol
Diskussion
Im Anschluss an die Versuche wurden die
berechneten Werte der Versuchsgruppen diskutiert!
Die Abweichungen vom Literaturwert betrugen
maximal 10% !! Nach Meinung unseres Chemielehrers war dies ein überraschend
gutes Ergebnis! Wir kamen zu der Meinung, dass die Ursachen für die
Abweichungen zunächst methodisch
bedingt seien, aber auch mit kleineren individuellen
Fehlern bei der Durchführung zu erklären sein könnten!
Diese Seite wurde in
Zusammenarbeit mit H. Mahal von Magnus Baringer, Kl.9b erstellt!